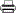e-IRB
IRB(Institutional Review Board, 의학연구윤리심의위원회)

- IRB
- e-IRB
서울대학교 의과대학과 서울대학교병원은 2009년 4월부터 CRIS 시스템을(e-IRB)cris.snuh.org)사용하고
있습니다.
e-IRB 시스템을 통하여 사용자들은 심의의뢰부터 결과통보까지 심의와 관련된 모든 업무를 수행할 수
있습니다.
- IRB과제 접수
- IRB심의 결과 및 심의의견 확인
- IRB심의 결과 통보서 출력
- IRB승인된 (IRB직인동의서) 다운로드
- GCP/ 연구윤리교육 기록 등록 및 교육 이수증 출력
e-IRB 시스템 사용 매뉴얼을 반드시 참고하여 주시기 바랍니다. ( 다운로드)
다운로드)
e-IRB ID 로그인 (https://cris.snuh.org)
-
원내 연구자
초기설정 아이디: 개인번호 / 비밀번호: 주민번호 뒷자리 (신임 연구자의 경우 의생명연구원 전산실
(2072-1614)로 아이디 발급 신청을 할 수 있습니다.) -
외부 담당자(CRA)
w 발급 승인된 ID로 로그인
w 신규 CRA ID 발급이 필요한 경우, e-IRB시스템 로그인 화면의 [※의뢰사 회원가입]을 통해 신규 ID 발급 신청 (*IRB 관리자의 사용 승인 이후부터 e-IRB시스템 로그인 가능)
※ CRA ID는 담당하는 과제의 [의뢰자]를 기준으로 발급되고 있습니다.(ID가 발급된 기관명이 IRB 심의 관련 문서에 ‘의뢰자’로 출력됩니다.)
※ CRO소속이신 경우, 담당하는 과제의 ‘의뢰자’별로 각각 ID를 발급 받아 이용하시기 바랍니다.
연구자 권한위임 방법
- 책임연구자가 해당 연구에 참여하는 공동연구자에게 권한 위임을 하면, 위임 받은 연구자는
본인의 계정에서 IRB 심의현황을 확인하고 보고서를 작성할 수 있습니다.
(단, 보고서 제출시에는 위임 받은 연구자가 보고서를 작성하더라도 책임연구자의 확인 후 IRB에
제출이 가능합니다)
- * 권한위임 방법
- ① 책임연구자의 ID로 로그인하여 [연구기초과제관리] 선택
- ② 권한 위임할 과제를 선택하여 [권한 위임] 클릭
- ③ 하단의 [위임자]를 검색하여 권한기간을 설정 후 권한 부여 가능
신규과제 제출 방법 (e-IRB 시스템 사용 매뉴얼 참조)
- * 연구자 주도연구
- ① 책임연구자의 ID로 e-IRB시스템에 로그인
- ② [연구기초과제관리]에서 기초과제 명 등록 (연구형태 [17-IRB제출과제]로 선택)
- ③ [IRB 심의의뢰 및 현황] 화면 하단의 [신규작성] 선택하여 [연구계획 심의의뢰서(신규)] 작성
- ④ 작성 완료 후 [연구자확인 및 제출] 버튼 클릭 후 IRB 지원실에서 최종 접수
- * 의뢰자주도 연구
- ① 발급 승인된 CRA ID로 e-IRB시스템에 로그인
- ② [IRB 심의의뢰서] > [기초과제관리] > [의뢰사 기초과제관리]에서 본 기관 책임연구자와 신규 기초과제 명 등록 (*CRA 권한으로 입력된 기초과제명은 IRB 관리자의 사용 승인 이후부터 검색/사용이 가능)
- ※ 신규 CRA ID 발급 신청 시, ID 발급 신청 화면 하단의 체크박스를 클릭하면 신규 기초과제 명 등록을 함께 요청하실 수 있습니다.
- ③ [IRB 심의의뢰 및 현황] 화면 하단의 [신규작성] 선택하여 [연구계획 심의의뢰서(신규)] 작성
- ④ 작성 완료 후 CRA가 [연구자확인 및 제출] 버튼 클릭 후 책임연구자에게 확인 요청
- ⑤ 책임연구자가 [연구자확인 및 제출] 버튼 클릭 후 IRB 지원실에서 최종 접수
그 외에 추가 보고서 (변경, 이상약물반응, 변동/위반, 연차, 종료 등) 작성 방법
[IRB 심의의뢰 및 현황]에서 해당과제목록의 추가작성[작성] 클릭 후 작성할 보고서를 선택하여 내용 기입 후 제출
- ① [IRB 심의의뢰 및 현황]에서 상단의 과제 목록 중 해당 과제 명 클릭
② 작성이 필요한 보고서 서식을 선택 후 [추가작성] 선택
③ 작성 완료 후 [연구자확인 및 제출] 버튼 클릭 후 IRB 지원실에서 최종 접수
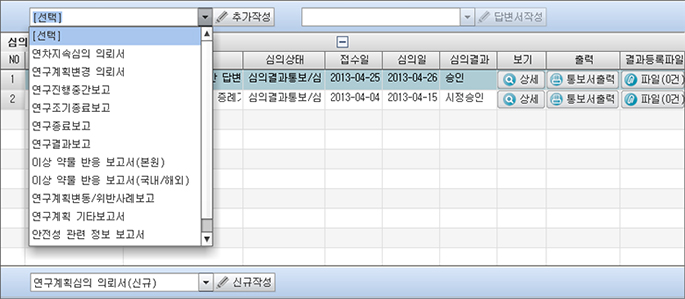
IRB지원실 최종 접수 전 [재검토]요청 사항 확인 방법
- IRB에 제출된 모든 보고서에 대하여, 필수 서류 등이 미비 되거나 의뢰서의 기술이 부정확한 경우,
IRB접수 전
“재검토” 요청될 수 있고, 책임연구자에게 자동으로 [재검토의견] 메일이 발송 됩니다. (병원 내 연구담당자 또는
SIT 과제여서 CRA 가 있는 경우에는 연구담당자와 CRA에게도 메일 발송됨) - IRB에 최종 제출 전 각 보고서 필수 체크 항목에 대하여 꼼꼼히 검토 부탁 드립니다.
* 재검토 요청사항 확인방법
① [IRB 심의의뢰 및 현황]에서 상단의 과제 목록 중 해당 과제 명 클릭
② 해당 보고서의 [상세] 클릭하면 팝업 창으로 [재검토] 의견 확인 가능
③ 하단의 [재검토의견] 버튼 클릭하면, 다시 확인 가능.
④ 재검토 요청 사항에 대하여 수정 완료 후 다시 [연구자 확인 및 제출] 버튼 클릭
① [IRB 심의의뢰 및 현황]에서 상단의 과제 목록 중 해당 과제 명 클릭
② 해당 보고서의 [상세] 클릭하면 팝업 창으로 [재검토] 의견 확인 가능
③ 하단의 [재검토의견] 버튼 클릭하면, 다시 확인 가능.
④ 재검토 요청 사항에 대하여 수정 완료 후 다시 [연구자 확인 및 제출] 버튼 클릭
GCP/연구윤리교육 관리
- 본인이 이수한 GCP 및 연구윤리교육에 대한 기록을 등록하고, 임상연구윤리센터에서 주최한 교육인 경우 이수
여부
확인 후 [교육 이수증]을 직접 출력할 수 있습니다.
* GCP/연구윤리교육 관리
- [GCP/연구윤리교육관리]에서 본인이 이수한 관련 교육 목록 확인
- 해당 교육 과제 클릭 후 하단 [이수증 출력]에서 교육이수증 출력 가능
*
공동연구자의 교육 이수 확인 방법
- 초기심의의뢰서 작성 시 공동연구자 명단에서 공동연구자의 GCP 이수 기록을
확인하실 수 있습니다.